减数分裂是生殖细胞发育过程中的一个特殊阶段,从启动至结束的整个过程,基因表达呈现高度有序的动态变化,其调控因素非常复杂。在有丝分裂到减数分裂的过渡中,视黄酸(RA)信号通过诱导减数分裂调节因子STRA8的表达,在精原细胞发育为初级精母细胞的过程中发挥关键作用。在小鼠睾丸中,STRA8与其分子伴侣MEOSIN协同作用,促进生精细胞从有丝分裂进入减数分裂,并驱动减数分裂基因的表达,以维持减数分裂各遗传学事件(如同源染色体配对、联会、重组和分离)的正常发生。减数分裂重组始于SPO11在“热点”区域产生的数百个DNA双链断裂(DSB);随后,断裂的DNA末端装载单链DNA结合蛋白,伴随着SYCP1等蛋白形成的联会复合体组装,同源染色体相互识别并发生联会。迄今,有关减数分裂启动及进程中的分子遗传调控尚未完全阐明。组蛋白甲基化和去甲基化对于调节染色质结构和基因表达至关重要。近年来,一些组蛋白去甲基转移酶被报道参与精子发生,但这些组蛋白去甲基化酶是否以及如何在减数分裂启动及进程中发挥作用,目前尚不清楚。
2024年8月19日,华中科技大学同济医学院生殖健康研究所袁水桥团队联合中国科学技术大学附属第一医院江小华团队在The EMBO Journal上发表题为“Histone demethylase KDM2A recruits HCFC1 and E2F1 to orchestrate male germ cell meiotic entry and progression”的研究论文。该论文揭示了组蛋白去甲基化酶KDM2A在小鼠雄性生殖细胞发育中的重要作用,发现KDM2A通过募集转录因子E2F1及其辅因子HCFC1调控减数分裂启动及进展相关靶基因(如Stra8、Meiosin、Spo11和Sycp1等)的转录表达,从而促进生精细胞启动减数分裂阶段并完成整个减数分裂进程。

研究团队首先发现在生殖细胞特异性敲除Kdm2a会导致雄性小鼠完全不育,减数分裂启动受到严重影响,精子发生最终停滞在减数分裂偶线期。RNA-seq分析表明,KDM2A能够抑制精原细胞发育相关基因的表达,并促进减数分裂所需基因的转录激活。有趣的是,通过CUT@RUN-seq分析,研究团队发现KDM2A在雄性生殖细胞能够有效催化其靶基因组区域H3K36me3的去甲基化,这表明KDM2A可能在生殖细胞中作为H3K36me3去甲基酶发挥功能,不同于其在体细胞中作为H3K36me2去甲基酶的传统功能。
此外,研究团队发现KDM2A能够与转录因子E2F1及其辅因子HCFC1相互作用,并将它们募集到减数分裂所需的关键基因(如Stra8、Meiosin、Spo11和Sycp1)的启动子上以调控这些靶基因的转录表达,从而使精原细胞成功进入减数分裂并完成整个减数分裂进程。
该研究揭示了KDM2A在生殖细胞发育中的重要作用,从新的角度提出了组蛋白修饰酶和转录因子在减数分裂启动时协同调控关键基因转录表达的分子机制假说(图1)。值得一提的是,袁水桥教授团队于2024年7月19日在Genome Biology上还报道了m6A甲基化酶METTL16介导的基因选择性剪接及翻译效率调控参与减数分裂启动的分子新机制(Genome Biol,2024)。本研究是合作团队在减数分裂启动及进程中的又一新发现,为临床上由减数分裂异常导致的非梗阻性无精子症患者的诊断提供了新的理论视角。
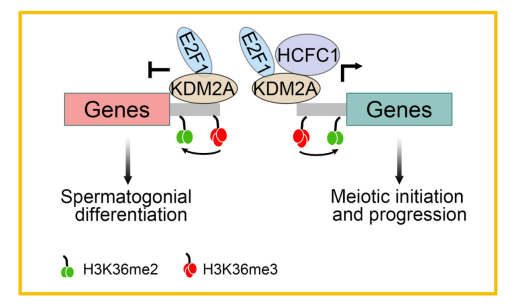
图1. KDM2A调控基因表达和生殖细胞发育的模式图
华中科技大学同济医学院生殖健康研究所/实验动物中心丰胜磊博士(现为湖南大学生物学院副教授)、华中科技大学同济医学院生殖健康研究所博士生桂以倩、西南民族大学畜牧兽医学院殷实为该论文的共同第一作者,华中科技大学同济医学院生殖健康研究所/实验动物中心袁水桥教授和中国科学技术大学附属第一医院江小华博士为共同通讯作者。华中科技大学同济医学院生殖健康研究所为论文的第一通讯单位,该研究得到了国家自然科学基金、华中科技大学基础研究支持项目等资助。(文图 丰胜磊 桂以倩)
文章链接:https://www.embopress.org/doi/full/10.1038/s44318-024-00203-4

 官方微信公众号
官方微信公众号